什么是OD260 /OD 230 ?
核酸所含嘌呤和嘧啶分子具有共軛雙鍵,在260nm波長處有最大吸收峰。鹽離子等其他污染物在OD230處有最大吸收峰,所以OD260 / OD 230用來評估樣品中是否存在一些污染物,如碳水化合物,多肽,苯酚等,較純凈的核酸OD260 / OD 230 的比值應大于2.0。
如何提高OD260 /OD 230 ?請先看小新做的幾個實驗。
以下實驗均是使用Simgen全血DNA小量試劑盒(Cat.No.3001050)從400 μl全血中分離純化的基因組DNA,在微量紫外分光光度計上測定的核酸數據。
第一輪,按照說明書常規步驟操作,加完洗滌液Buffer WA后立即離心,測定結果如下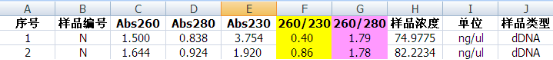
測定結果中OD260 / OD230比值太低,是不是表明里面的鹽分等污染物殘留太多了?我們之所以控制OD260 / OD230比值,主要是為了下游實驗不受影響,因為有些污染物會對后續的一些反應實驗產生抑制作用。為了知道本次提取的DNA對PCR實驗有沒有影響,小新取了18μl作模板(40μl體系)進行全血1.3 kb PCR擴增。結果顯示,PCR擴增并沒有任何抑制現象。
下面是PCR產物電泳圖:

實際上單純從OD260 / OD 230的數值上來判斷鹽分是否殘留過高并不準確:即使殘留相同濃度的鹽分在核酸溶液中,某些鹽分在230nm處有強吸收峰的,也會嚴重降低OD260 / OD 230的比值。但這并不等于核酸就不能使用了,第一輪實驗獲得的DNA用作PCR的模板并沒有出現抑制現象就證明了這一點(本次PCR體系40 μl,加入了接近一半反應體系(18 μl)的模板)。當然,也正是因為這種在230nm有強吸收峰的雜質的存在,為我們提供了減少鹽分殘留的線索。
雖然PCR實驗沒有因為OD260 / OD230比值低受到影響,但是如果有辦法提高這個比值豈不是更好。之后,小新踏上了提高OD260 / OD230比值之旅。
第二輪實驗,小新在原有步驟上做了一點改變:在加完洗滌液Buffer WA后蓋上核酸純化柱的蓋子靜置了5min再離心,最后的實驗數據OD260/OD230平均值就有了明顯的提高。看下圖,

說明浸泡洗滌法是有用的,但是還是離2.0以上相差甚遠。
第三輪實驗,小新又重做一遍,其他條件都不變,在加完Buffer WA后開蓋靜置5min,最終測定的實驗數據OD260/OD230的值均已超過1.5,有一組數據已經到達2.0以上。

同樣都是靜置,這兩輪實驗最終造成不同的結果,這是什么原因呢?第二輪實驗在加洗滌液Buffer WA后室溫靜置了5 min, 其目的就是讓吸附膜上殘留的鹽分等污染物更充分地溶解到洗滌液中。第三輪實驗中加了洗滌液Buffer WA后開蓋靜置,可以使核酸吸附膜的上下的氣壓保持平衡,洗滌液在重力的作用下會緩慢滲透過吸附膜(如果仔細觀察,會發現洗滌液有滴下的趨勢),這樣鹽分等污染物就會沖洗得更徹底,所以最后OD260/OD230的比值會更高。
如果采用第三輪實驗方案還覺得鹽分殘留高的話,就要考慮除吸附膜之外鹽分殘留的來源了。第四輪實驗,小新在加洗滌液Buffer WA時,吸頭在核酸純化柱管口沿著管壁一圈清洗下去,然后再開蓋靜置5min。最后的測定數據十分完美,全都在2.0以上。

由于在靠近純化柱管口,就是與管蓋接觸的周圍部分是洗滌液最難清洗到的死角,所以第四輪實驗在加洗滌液Buffer WA時,吸頭對準核酸純化柱管口沿著管壁一圈清洗下去,然后再開蓋靜置5min,則能將管壁上殘留的雜質也全部帶走,所以最后的測定數據也全都在2.0以上了。
看完這幾個實驗,我們可以把提高核酸OD260/OD230的方法歸納為兩個,其一是浸泡法,其中開蓋靜置比閉蓋靜置的效果要好很多,浸泡時間在5-10分鐘左右。其二是沖洗法,沖洗易被忽略的死角,將污染物去除的更徹底。兩個方法都可以在一定程度上提高核酸OD260/OD230,提高核酸純度,讓下游實驗無后顧之憂。
新景實驗室